在多相催化反应过程中,化学反应在催化物表面发生,催化剂能否有效加速反应进行是至关重要的一步,但是,对于金属催化剂来说,其活性受元素组成、化学状态、尺寸大小、晶面结构等各种错综复杂的因素影响,极其细微的结构变化便可带来巨大的性能改变,给控制金属催化剂性能造成巨大的困难。但是有一种神奇的理论,提出只要研究金属催化剂的单个个变量就可以有效的判断其活性,这里我就来介绍这个神奇的理论——d带中心理论。
我将介绍d带中心模型是什么,它是如何表示出吸附能大小的,之后再介绍金属的配体效应和拉紧效应如何影响d带中心。
什么是吸附
首先要介绍在催化中吸附的本质是什么。对于化学吸附可以认为是漂浮在空中的气体分子(之后简称为吸附质),与催化剂表面(在这里是金属表面)形成化学键,这就是吸附。那形成化学键又意味着什么呢?要从能量角度来解释的话,我们可以理解为:吸附后,也就是化学键形成后,吸附质和金属表面的总能量降低了。
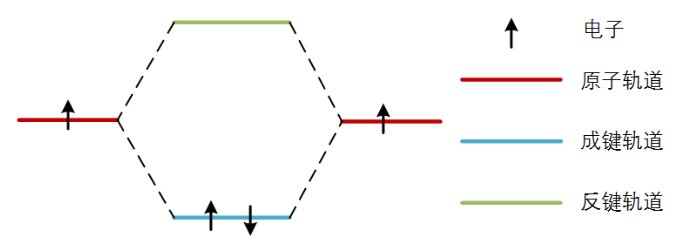
图1 双原子靠近形成杂化分子轨道
我们首先从两个原子的相互作用解释化学键的现象,如图1所示,当两个原子相互靠近形成双原子分子时,它们的原子轨道会杂化形成一个能量低于两原子轨道的分子轨道,和一个能量高于两个原子轨道的分子轨道,能量低的称为成键轨道,能量高的称为反键轨道。如果原子轨道上各有一个电子(一个轨道上只能容纳两个自旋方向相反的电子),它们跑到成键轨道上,那么它们的能量就比原来呆在原子轨道时要低,也就是说它们呆的更爽了,这就是化学键降低系统总能量的原理。当原来的两个原子轨道上各有两个电子时,那就有两个电子跑到成键轨道,两个电子跑到反键轨道。反键轨道的能量非常高,这时的成键反键轨道上电子能量加起来比这四个电子呆在原来原子轨道上能量还高,那还不如不杂化,自己在自己轨道上呆着得了,所以反键上填充电子会降低成键的不稳定性,要成键稳定,反键轨道上越空越好。
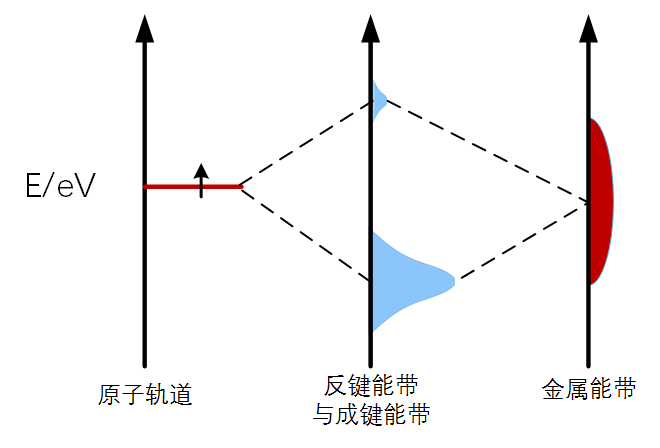
图2 原子轨道与金属能带耦合作用
再来分析金属表面和吸附质的情况,当吸附质靠近金属表面时,吸附质的原子轨道与金属的能带(大量的金属原子轨道分裂后堆积成能带)相互耦合,产生了成键能带和反键能带(这是我为了方便说出来的,并不是一个准确的术语),如图2所示,纵坐标为能量E。金属上的电子跑到成键能带上,系统能量降低,可以认为吸附质吸附在金属表面,放出能量(其实这个成键能带受金属的影响非常复杂,但不是这里的重点,可以忽略掉),跟分子轨道一样,反键能带上填充电子越少,成键越稳定。
什么是d带中心理论
那么d能带中心到底是如何影响吸附能的呢?接下来就有请norskov大神登场了。对于过渡金属来说,可以把总的能带拆成sp、d和其他能带,在这里只分析sp和d能带。什么是sp和d能带呢?原子中的核外电子的运动区域由里到外可以分成很多个电子壳层,命名为K、L、M、N…层。而每个壳层里面运动的电子角动量不同,根据角动量的差异分成不同的电子亚层:s、p、d、f… 1s称为第一个电子壳层中的s亚层,2p称为第二个电子壳层中的p亚层。s、p层能级容易相互作用形成sp能级,当很多原子聚集到一起时,sp能级就叠加形成sp能带,d能级叠加形成d能带,如图3所示。sp能带由于是sp相互作用形成的,其能量范围非常宽泛,d能带范围比较局部,一般在费米能级附近。(0K时电子填满低于费米能级的能级,而费米能级以上的能级没有电子填充,在常温的时候会有一小部分电子激发到费米能级以上,因为本文考虑的是所用价电子的总能量,这部分因温度升高激发到费米能级的电子可以忽略,仍然认为低于费米能级电子占满,高于费米能级没有电子)
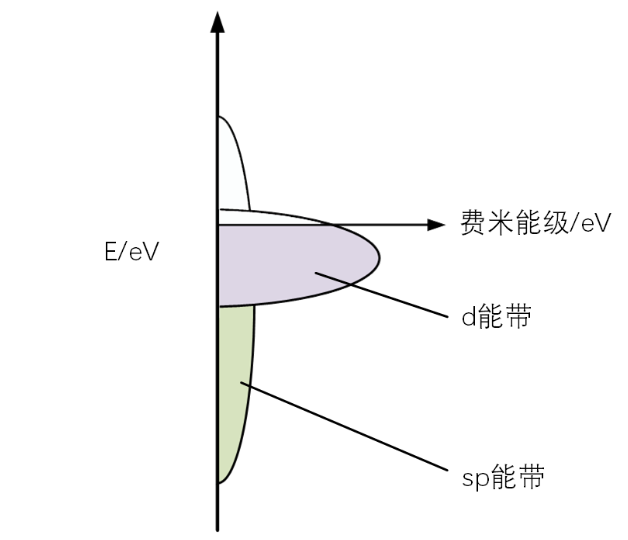
图3 金属上的sp能带与d能带
我们来解释O原子吸附在Pt金属表面的过程,O原子有8个核外电子,有四个电子先填满1s和2s轨道,剩下四个电子填充在2p轨道,但是2p轨道有6个空位呀,因此2p轨道率先伸向Pt金属表面勒索电子。当2p轨道的魔爪伸向Pt表面时,迎面而来的是金属表面的sp能带,如图4所示。
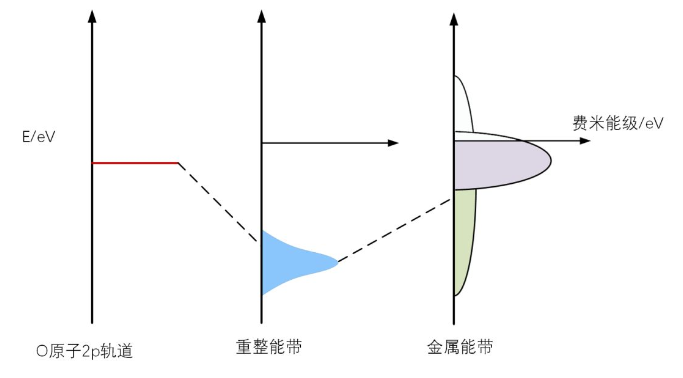
图4 O的2p轨道首先与sp能带杂化
2p轨道和sp能带相互作用耦合形成了一个能量接近sp能带底的成键能带,我们称为重整能带,这个重整能带能量低到sp能带的底部,因此被电子填满,O就得到电子成为O^2-。当然,它们相互作用也会产生反键能带,但是因为sp能带非常的宽,产生的反键能带远高于费米能级,不会被电子填充,因此不会影响成键的稳定性,在这里不需要考虑反键能带。
这个重整能带的能量能不能进一步降低呢?可以的,这时候金属的d能带就出场了。如图5所示,d能带和重整能带发生耦合,形成一个能量低于重整能带的成键能级和一个能量高于d轨道的反键能带,这里称为最终键合能带。如果这时候反键能带被电子填充的少,也就是高于费米能级的部分越大,成键越稳定;反键能带被电子填充的多,也就是高于费米能级的部分越小,成键越不稳定。
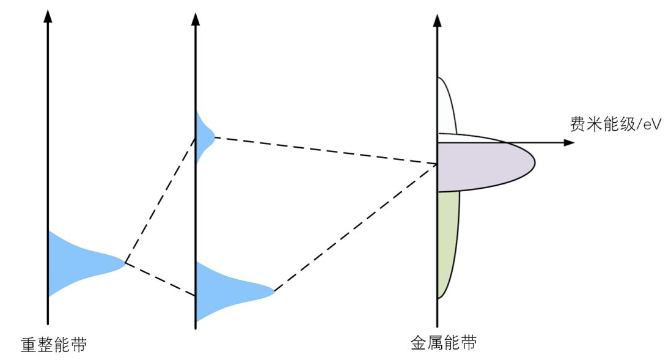
图5 d能带与重整能带耦合
根据上面的分析,最终吸附质O与金属表面成键的稳定性是由sp能带与2p轨道耦合,d能带与重整能带耦合两个步骤所影响的。 norskov认为,对于所有过渡金属来说,在第一步2p轨道和sp能带形成的重整轨道能量范围和形状都差不多,可以认为所有过渡金属在第一步形成的重整能带都差不多,因此第二步的d带能带起到很重要的作用,如果我们说d能带的中心决定了第二步形成的反键能带能量范围,那么d能带中心的能级高低决定了反键能带被电子填充的程度,从而决定了吸附成键的稳定性和强度,这就是d带中心理论。
d带中心位置如何影响吸附强度
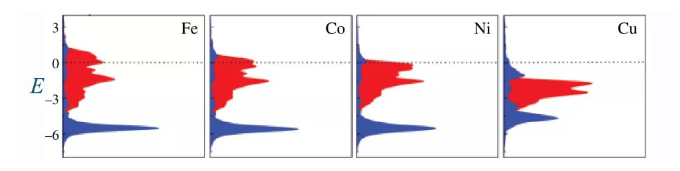
图6 不同过渡金属的d能带与最终键合能带关系[1]
图6中红色是金属的d能带,蓝色是最终键合能带,虚线是费米能级。四个图分别是Fe、Co、Ni、Cu四个金属表面的吸附情况。我们可以看到,从左到右d能带能量逐步降低,也就是d中心降低,耦合产生的反键能带降低,更多部分的反键能带低于费米能级,从而被电子填充,降低了键合的稳定性,吸附强度降低。
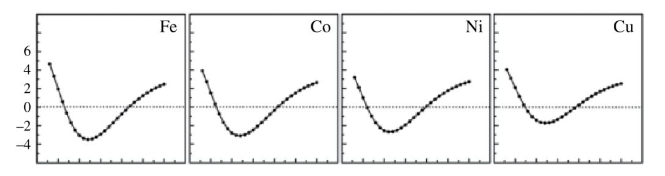
图7 不同过渡金属吸附能对比[1]
图7横坐标是O离金属表面的距离,纵坐标是吸附能大小,由于吸附是两者结合放出能量,纵坐标越负表示吸附能越大,我们选择能量最低点作为最佳吸附点。结合图6我们可以看到,从右到左金属d带中心逐个上升,吸附能逐个增强,说明d带中心上移可以增强吸附能。
接下来我们可以根据元素周期表总结一下过渡金属与吸附能的规律。如图8所示,在同一周期的金属元素中,从右到左d带中心单调上升,吸附增强。第一、二、三行元素价电子对应的d能带分别是3d、4d、5d,从3d到4d到5d,从上到下看,耦合的强度逐渐降低,吸附能单调下降。
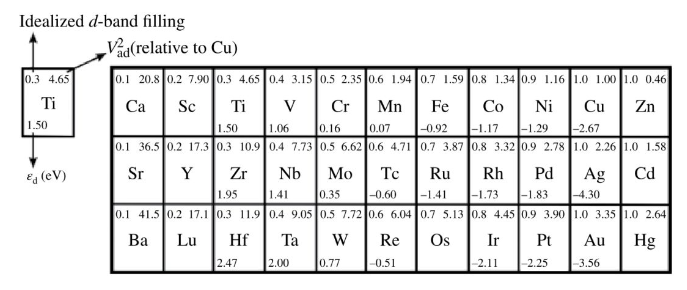
图8 过渡金属周期表[1]
配体效应如何影响d带中心的位置
接下来解释配体效应如何影响d带中心从而影响吸附能。金属表面配位数 差异导致d带中心的移动。什么是表面配位数差异呢?配位数是金属中最邻近和次临近原子数,比如面心立方体的Pt配位数是12,如图9
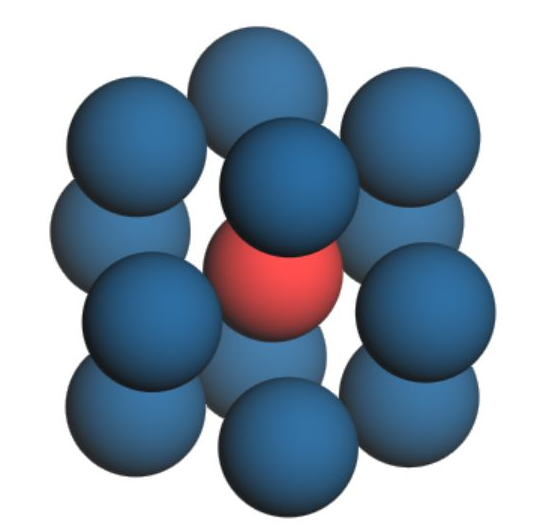
图9 中心Pt原子周围有12个原子,配位数是12
由于表层原子没有了外围一层原子的包围,它们的配位数没有12,对于Pt的基础晶面(100)、(110)、(111)上的原子配位数分别是8、7和9,如图10所示
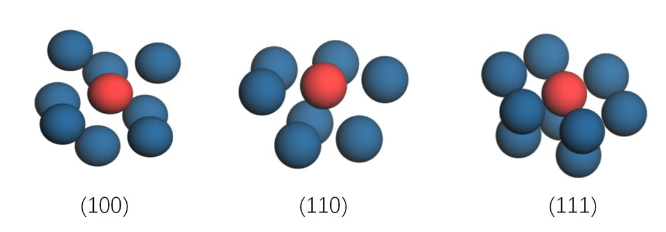
图10 Pt不同基础晶面表面原子的配位数
由图10可得,(110)有最低的配位数,表面原子排布最疏;(110)有最高的配位数,表面原子排布最密。当原子越密,波函数重叠更充分,能级分裂程度增强,就会产生更宽的能带。(111)表面原子排布最紧密,能带越宽。那能带宽度和d带中心高度有什么关系呢?可以根据图11说明
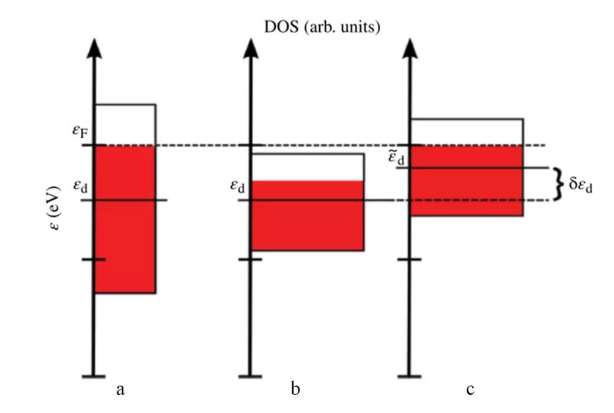
图11 能带宽度对d带中心位置的影响,εd为d带中心[1]
当能带从宽变窄时,从图11a到11b,因为能带宽窄不会影响总的能级数,所以形状会更加扁平,而且金属中填充的电子数是不变的,也就是费米能级以下那部分面积是不变的(红色面积),因此变窄后整个能带要上移来保持填充电子数不变,能带从图11b位置上移到图11c,d带中心也会随之上移。因此,表面排布越紧,能带分布越宽,d带中心越低,吸附能越弱。三个基础晶面紧密程度(111)>(100)>(110),吸附能大小(111)<(100)<(110),反应活性(111)<(100)<(110)。
拉紧效应如何影响d带中心位置
拉紧效应同样可以通过带宽解释。如果在其他的过渡金属表面生长一层Pt原子时,假如基底的金属晶格常数大于Pt,那么Pt就会被拉伸,晶格常数增大,如图12所示,那么Pt原子排布会变疏,原子间波函数重叠减少,能带变窄,d带中心上移。
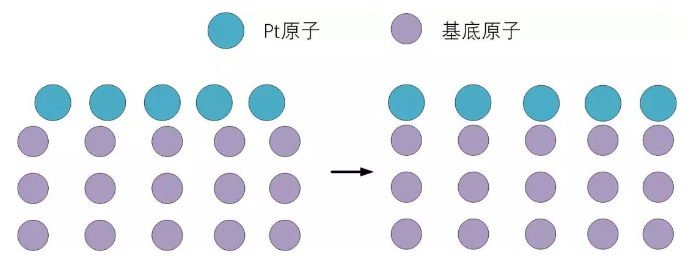
图12 铂原子在基底原子作用下拉伸,晶格常数增大。
作者:新用户06349574
原文链接:http://www.360doc.com/content/22/0808/03/72666197_1042954004.shtml
来源:个人图书馆